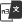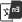采用中国仓鼠卵巢细胞(CHO)生产重组蛋白过程中的乳酸积累是常见的现象,通过乳酸代谢可以窥探出细胞生长代谢的综合状况。
本文综述上游工艺开发过程中的乳酸积累原因与问题解决方案,同时根据细胞培养过程中乳酸检测结果提出新的观点。

葡萄糖代谢在细胞生长、目标蛋白表达过程中具有十分重要的地位。



图2:典型的Fed-batch细胞生长和乳酸代谢趋势图

如图3,Fed-batch培养中当细胞密度第4天达到峰值开始进入稳定期,乳酸达到2.5 g/L后开始下降,而后培养第6天开始,细胞乳酸并不继续消耗,培养第10天后,乳酸快速增加,最后达到3.3 g/L。综合其它参数如细胞活率下降较快,频繁补碱,且此批次最后产量明显下降看出此批次乳酸代谢为异常代谢。



图4:乳酸异常代谢发生后典型的细胞液变化

细胞株的影响
现今广泛使用的基因随机插入CHO宿主细胞,导致宿主细胞原有的代谢体系发生改变,转染后筛选的不同克隆之间细胞代谢特性可能有较大差异,这导致在不同克隆中出现不同的乳酸代谢速率。
细胞在传质不足时导致营养供应不足、细胞微环境溶氧不足,从而导致糖代谢不完全,造成乳酸积累,如在50ml转管、摇瓶中培养中细胞液装量过大、摇床转速不足,在生物反应器中搅拌桨过小、搅拌转速不足。
葡萄糖作为糖代谢的底物,增加底物浓度促进糖代谢,在细胞难以消耗更多能量情况下出现乳酸积累造成pH下降。
谷氨酰胺同样可通过代谢路径进入糖代谢,过量谷氨酰胺进入培养基体系造成乳酸严重积累。
铜离子是乳酸代谢及细胞生长的关键,当培养基铜离子不足且消耗殆尽,细胞开始出现乳酸异常代谢特征。
高二氧化碳累积造成线粒体功能下降,导致细胞需要通过乳酸生成路径获得补充能量,此种情况时常发生在大型生物反应器中。



乳酸对于细胞并不是有毒成份或副产物,相反乳酸是细胞的营养物,在一些案例中培养基中添加乳酸可以降低铵离子积累和提高产量。
乳酸是细胞代谢的特征产物,常被用于检测细胞代谢状况,细胞代谢过程中除了乳酸外有如苹果酸、延胡索酸、柠檬酸等中间代谢产物,在一些案例中,乳酸并没有积累,细胞pH同样失控持续下降导致细胞过早凋亡。乳酸异常代谢过程的评判需要进一步结合细胞液pH变化,异常的乳酸代谢通常伴随pH下降。在一些案例中如图5,乳酸虽然累积且没有下降,但细胞液pH持续上升,蛋白表达和pH控制良好。
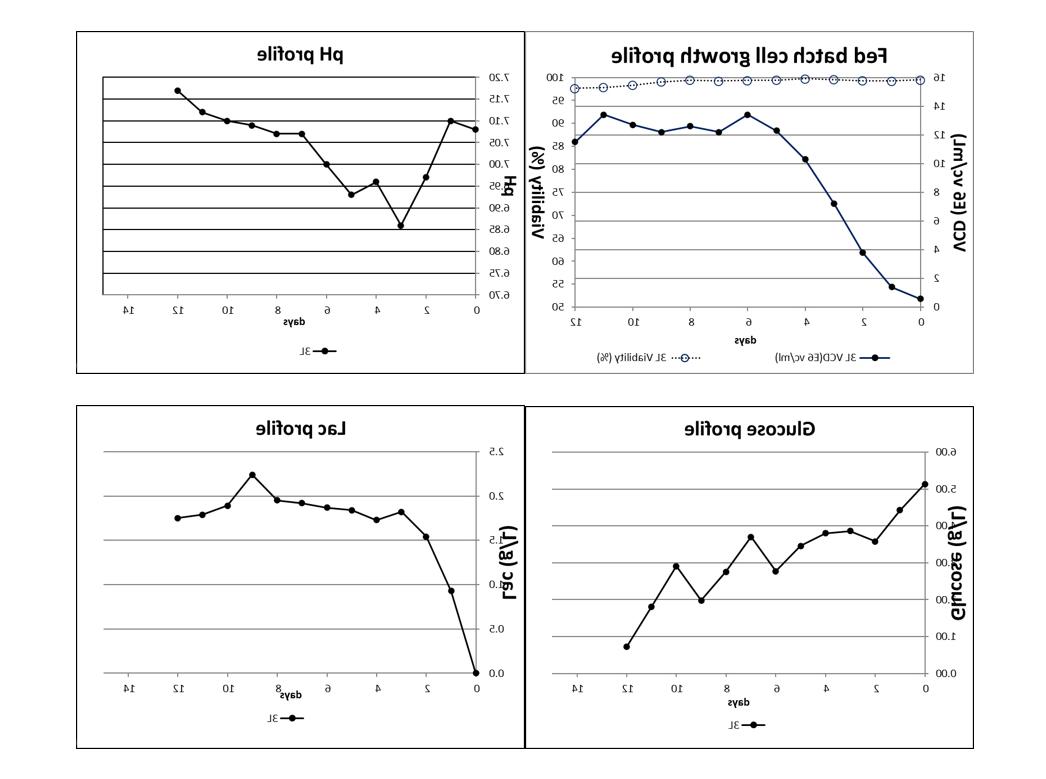
图5:可能认为乳酸异常代谢的案例


参考文献
Fiona Hartley, Tracy Walker, Vicky Chung, Karl Morten. Mechanisms driving the lactate switch in Chinese hamster ovary cells[J]. Biotechnology and Bioengineering. 2018 Aug;115(8):1890-1903
Jamey D Young. Metabolic flux rewiring in mammalian cell cultures[J]. Current Opinion in Biotechnology. 2013 Dec;24(6):1108-15
Brunner M, Doppler P, Klein T, Herwig C, Fricke J. Elevated pCO2 affects the lactate metabolic shift in CHO cell culture processes[J]. Eng Life Sci. 2017 Dec 19;18(3):204-214
Li J, Wong CL, Vijayasankaran N, Hudson T, Amanullah A. Feeding lactate for CHO cell culture processes: impact on culture metabolism and performance[J]. Biotechnol Bioeng. 2012 May;109(5):1173-86
Zagari F, Jordan M, Stettler M, Broly H, Wurm FM. Lactate metabolism shift in CHO cell culture: the role of mitochondrial oxidative activity[J]. N Biotechnol. 2013 Jan 25;30(2):238-45